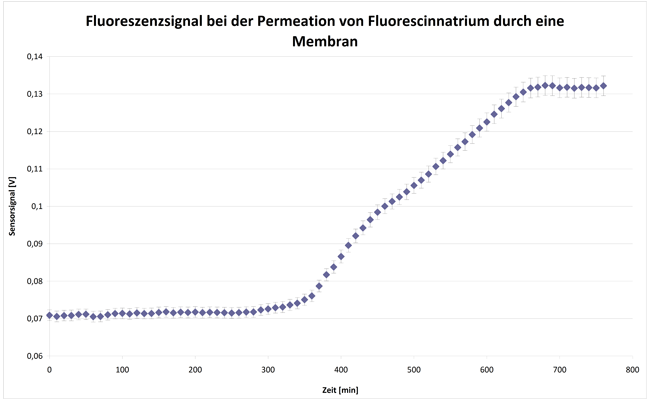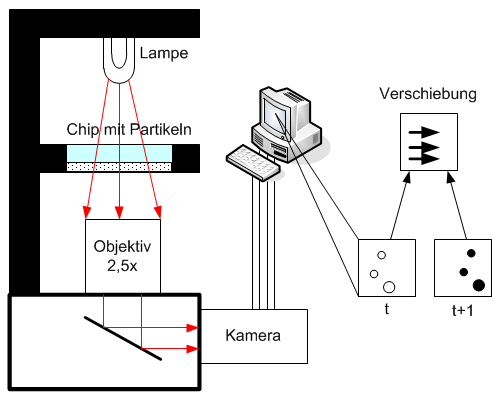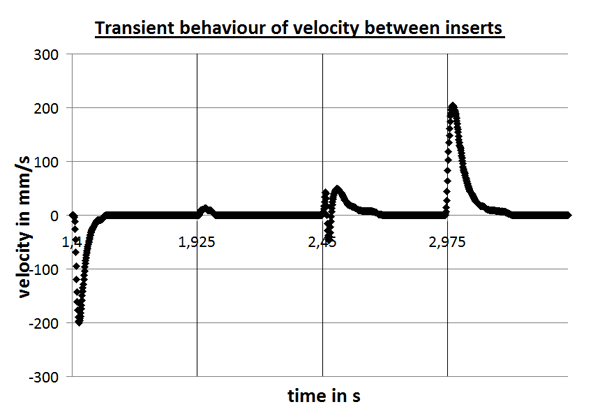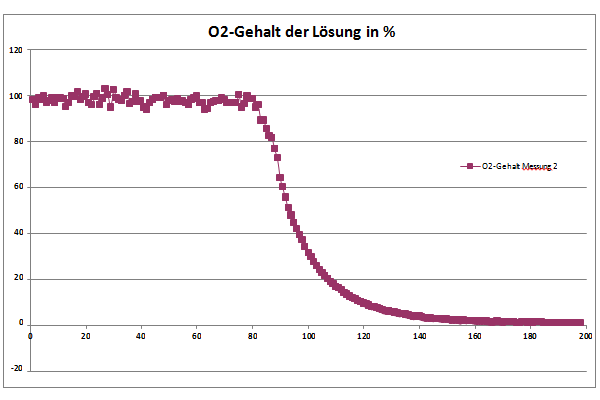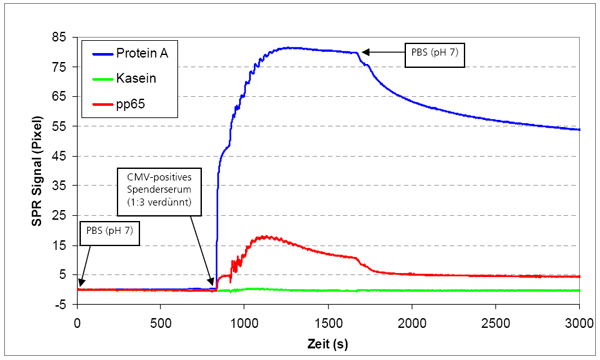
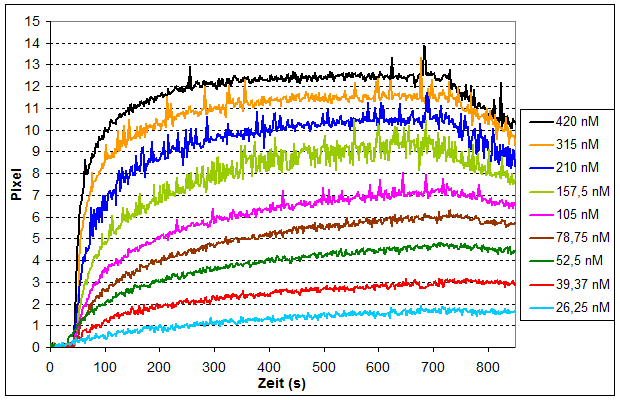
Lab-on-a-Chip, das miniaturisierte Labor auf einem Chip, steht für komplexe Systeme zur parallelen Abfrage mehrerer Zielparameter aus einer Probe. Basis für die Lab-on-a-Chip-Entwicklung bildet das am Fraunhofer IOF entwickelte SPR-Messgerät, das aus einem Auslesesystem und den dazugehörigen SPR-Chips besteht. Um kleinste Probemengen mit einem bestmöglichen Signal-Rausch-Verhältnis zu vermessen, werden verschiedene Ansätze wie Dielektrophorese, Magnetophorese und hydraulische Fokussierung per Simulation auf die Anwendung optimiert. Die Umsetzung des entsprechenden mikrofluidischen Probenhandlingsystems erfolgt im Rapid-Prototyping-Verfahren.
Hersteller
- Fraunhofer IWS / Fraunhofer IOF
Funktionsprinzip
- Oberflächenplasmonenresonanz
- Signalsteigerung durch Nutzung verschiedener physikalischer Effekte während der Probenführung
Technische Daten
- Probenvolumen: < 60 µL
- Messdauer: je nach Anwendung von 2 min bis zu 2 h
- Analytenanzahl abhängig von der Immobilisierungsmethode (z.B. 17 Messflächen von 200 µm Breite bei Funktionalisierung mit inversem Micro-Contact-Printing)
Anwendungen
- Detektion genetischer Mutationen (DNA-Nachweis)
- Detektion phytopathogener RNA-Viren (RNA-Nachweis)
- Immunologische in vitro Testung von Substanzen mit künstlichen humanen Lymphknoten (Antikörper-Nachweis)
- schnelle Point-of-Care Diagnostik bakterieller Infektionen (Antikörper-Nachweis)
- Detektion verschiedener Substanzen in Wässern
- Substanztestung – Nachweis spezifischer Marker im Zellkulturüberstand
- Substanztestung – Nachweis von Wechselwirkungen zwischen Rezeptoren und Liganden
Vorteile
- Disposables – Polymere Chips sind kompatibel zur Massenfertigung
- Parallelität – bis zu 180 Spots pro Chip ermöglichen vielfältige Anwendungen bei gleichzeitiger Redundanz der Messung
- Non-Imaging SPR – keine intensitätsbasierte Auswertung sondern winkelaufgelöste Messung ermöglicht einfachere Fehlererkennung und größere Messsicherheit
- offenes System – Kombination der SPR Messung mit verschiedensten mikrofluidischen System abhängig von Ihren Bedürfnissen und Ansprüchen
- robust – keine bewegten mechanischen Teile
 Fraunhofer-Institut für Werkstoff- und Strahltechnik IWS
Fraunhofer-Institut für Werkstoff- und Strahltechnik IWS