

Die Herausforderung bei der Entwicklung komplexer Gewebekulturen besteht in der Integration von Versorgungskanälen zur Sauerstoff- und Nährstoffversorgung zur Aufrechterhaltung des biologischen 3D-Mikromilieus.
Funktionsprinzip
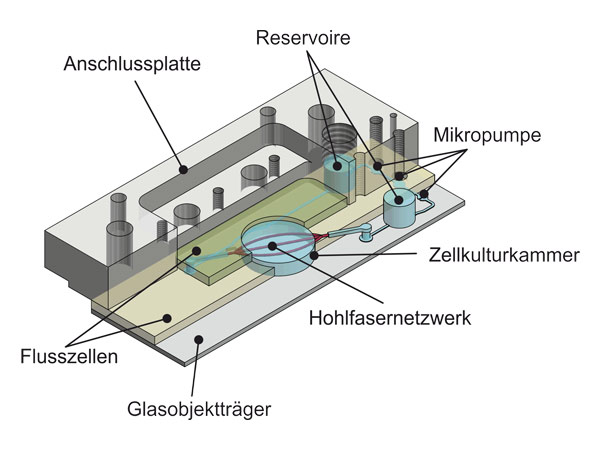
Die Multi-Organ-Chip-Plattform stellt die Basis für ein neuartiges Perfusions-Mikro-Bioreaktorsystem zur Kultivierung unterschiedlicher Gewebe in einem gemeinsamen Zirkulationssystem dar und ermöglicht die Charakterisierung von Interaktionen zwischen diesen.
Die Entwicklung von vaskularisierten 3D-Gewebekonstrukten kann über dreidimensionales Organ Printing realisiert werden. Die Anwendung von speziellen Zell-Matrix-Kompositen ermöglicht die Herstellung von permeablen Hohlfasern, die als 3D-Zellträger und gleichzeitig als künstliche Blutgefäße fungieren.
Die Schnittstelle zwischen den Hohlfasern und dem Mikro-Bioreaktorsystem ermöglicht die Medienversorgung der Zellen über das Zirkulationssystem des Perfusions-Mikro-Bioreaktors.
Anwendung
Mit der Weiterentwicklung der Technologie-Plattform wird ein neues leistungsfähiges Werkzeug für die Forschung und Entwicklung auf dem Gebiet der Geweberekonstruktion, Arzneimitteluntersuchung und für Zytotoxizitätsuntersuchungen bereitgestellt.
 Fraunhofer-Institut für Werkstoff- und Strahltechnik IWS
Fraunhofer-Institut für Werkstoff- und Strahltechnik IWS